
平成29年6月29日
(約3分で読めます)
活性酸素ってどんな酸素
近年、活性酸素は老化や色々な病気の原因になる悪者として嫌われ者になっています。
体の錆をくいとめる作用があると多くの健康食品や健康器具が宣伝されていますが、「酸化」、「活性酸素」が体に良くないのは分ったが、そもそも「活性酸素」とは何なのか、なかなか説明しているものが見当たらないのが現状です。「普通の酸素」と「元気な酸素」の二種類の酸素があるのだろうかと、疑問に思われている方は是非お読みください。
敵を知ることでより的確な対策を選択することが出来ます。
1. 皆さんがよくご存じの通り酸化とは 「酸化」は物質が酸素と結び付く事です。
電子を奪われる事、水素を奪われる事
さらに高校生になると、電子を奪われる事(電子を他に与える事)、酸・塩基の反応も含めて水素を奪われる事(水素を他に与える事)、「還元」はその反対と習われたと思いますがもうすっかりお忘れの事と思います。
化学の授業を始めるわけではないので、そうだったかな?ぐらいで結構です。
酸化について長々と書きましたが、まとめると次の3行になります。
「酸化」のまとめ
1.酸素と結合する事
2.水素を奪われる事
3.電子を奪われる事
昔、学校で習った原子の構造も活性酸素を正確に知るには必要になります。
簡単に説明しますので、ぜひお付き合いいただき昔の記憶を呼び戻してください。
原子の中心には原子核(陽子と中性子)が有り、その周りを陽子と同じ数の電子がまわっています。
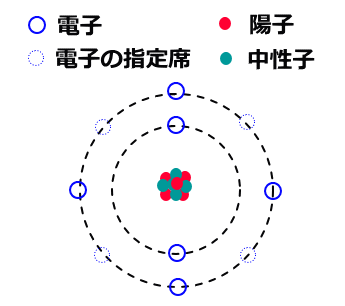
電子の回る殻は中心に近い方からK殻、L殻、M殻・・と続き、それぞれの殻には電子が入る指定席の数が2個、8個、18個・・・と決まっています。
最外殻の指定席が全部埋まった原子や、最外殻の電子が8個の原子は「ヘリウム」、「ネオン」、「アルゴン」などで安定して他の物質と反応しにくく、これらは希ガスと呼ばれています。
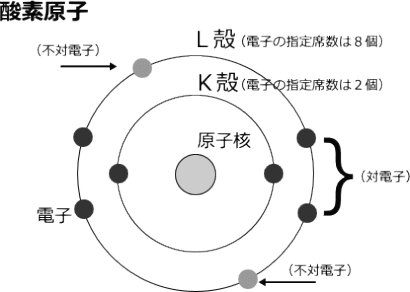
酸素の原子構造は下図のようになります。
酸素原子は図のように8個の電子を持ち最外殻のL殻に6個の電子が存在するので対(ペア)にならない不対電子(下図では灰色の丸)が2個存在します。
なぜ不対電子2個でペアに成れないのでしょうか?
人間世界もいろいろと小難しい決まりがありますが電子の世界にもいろいろと決まりがあります。
酸素原子の最外殻、L殻には電子が2個入り電子対(ペア)になる箱が4個あります。
一番外側のL殻には電子がペアで入る箱4個があるので箱が全て埋まり満席の状態では8個の電子が入る事が出来ます。
この2個入る箱には順番に1個づつ電子が埋められていき全部の箱に1個の電子が入り終わった後に2個目が各箱を埋めていきます。したがって一個の箱が空で、他の箱に2個電子が入る事通常は有りません。
L殻に6個の電子を持つ酸素原子はペアにならない箱が2個あるので不対電子を2個持つ事になります。
気体では酸素原子は単独で存在はせず2個の原子が互いの不対電子を共有して共有結合した酸素分子として存在します。酸素分子の状態では下図のように2個の不対電子(下図の灰色の小さい丸の電子)を持ちます。
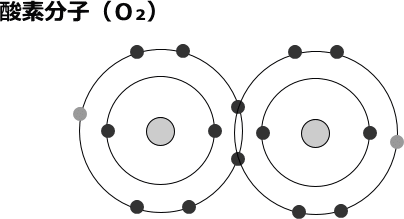
酸素は分子の状態では安定していますが、不対電子を持つため環境により周りから電子を奪おうとする性質も有ります。
ページ:1









